
Copyright
© 2000-2015
LHERBAUDIERE
3 pages à l'impression
22 mars 2013
 |
Copyright |
3 pages à l'impression |
version
initiale 2002 |
||
| dernière
mise à jour 22 mars 2013 |
CAPTEURS CHIMIQUES
|
un
problème difficile |
|||
|
solubles
ou non |
|||
|
inertes
ou vivants |
|||
|
à
quelle pression |
|||
une collection d'icônes pour visiter tout le site |
|||
Connaitre un environnement, un matériau de quelque nature qu'il soit implique le plus souvent l'exigence de connaitre sa nature chimique, d'abord de manière qualitative et ensuite de manière quantitative et, par suite, la chimie fait la part belle à de très nombreuses méthodes d'analyse. Il n'est pas question dans le cadre de ce site de les envisager toutes, mais plutôt de faire un tour d'horizon permettant au néophyte de s'orienter vers un type de technique plutôt qu'un autre en approfondissant sa connaissance, soit dans un ouvrage spécialisé, soit dans un site web spécifiquement dédié à ces méthodes.
En premier lieu on constate qu'une analyse chimique peut s'adresser à un milieu solide, liquide ou gazeux et les techniques, instrumentales ou non, mises en oeuvre seront bien différentes dans les trois cas; mais il faut noter dès à présent que dans la majorité des cas la procédure adoptée consistera à prélever un échantillon du milieu à analyser et à n'analyser que cet échantillon en supposant qu'il est représentatif du tout. Le second point important de différentiation concerne la nature inerte ou non du milieu à analyser : s'il s'agit d'un matériau inerte la méthodologie ne pose pas de problèmes particuliers, par contre s'il s'agit d'un matériau vivant on sera confronté au problème de l'évolution permanente du vivant. Ainsi il ne sera pas question de remettre au lendemain une analyse, ni de transporter un échantillon n'importe comment car ce ne serait plus le même et il serait généralement improbable de remonter à l'état initial.
Il existe une centaine d'atomes différents et des dizaines de milliers d'espèces chimiques identifiées et, dans un milieu donné, ces espèces peuvent être associées en grand nombre et interagir entre elles au gré de l'évolution des paramètres physiques caractérisant ce milieu. Il va donc être infiniment plus simple de caractériser les propriétés physiques d'un milieu que sa nature chimique ou biochimique.
Cas des matériaux à l'état solide
On va distinguer les matériaux de type métallique et les autres. Lorsqu'on veut analyser un échantillon métallique l'objectif est généralement d'identifier les divers atomes le constituant et leurs proportions. Pour cela on dispose de diverses techniques d'analyse en volume ou en surface décrites dans le chapitre concernant l'analyse des couches minces auquel nous conseillons le lecteur de se reporter. L'idée fondamentale est de bombarder l'échantillon à analyser avec un faisceau incident qui peut-être électronique ou photonique et même parfois ionique et d'analyser les émissions ou les réflexions qui en résultent.
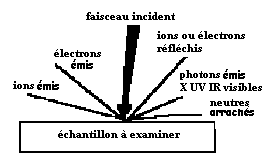
fig : schéma
simplifié montrant toutes les possibilités d'analyse exploitables
Lorsqu'il s'agit d'un granulat ou d'un matériau sous forme de poudre plus ou moins frittée (ex comprimé pharmaceutique), les méthodes atomiques n'ont que peu d'intérêt car ce sont les espèces chimiques à l'état moléculaire qui vont intéresser l'analyste et l'on est en général en présence de molécules très complexes. On va donc généralement tenter de solubiliser l'échantillon, soit dans l'eau, soit dans un solvant (ou un mélange de solvants adaptés) et on exploitera alors les méthodes d'analyse des composés à l'état liquide.
S'il s'agit d'un milieu inorganique et inerte, les méthodes chimiques traditionnelles sont nombreuses. On s'intéressera d'abord au pH de la solution afin de savoir s'il s'agit d'un milieu acide ou basique, éventuellement neutre ce qui orientera l'expérimentateur vers tel ou tel type de méthodes. Ensuite le problème sera de savoir si l'on recherche une espèce chimique en particulier (par ex: recherche de la présence de nitrates dans l'eau à usage domestique) ou si l'on souhaite une analyse complète. Dans le premier cas les chimistes disposent souvent de réactifs donnant lieu à des réactions colorées ou à des précipités solides et l'instrumentaliste va intervenir soit en identifiant l'intensité de la coloration, ce sont les méthodes dites colorimétriques (dont on donnera quelques exemples dans le chapitre sur l'analyse des gaz); soit en pesant la quantité de précipité solide par une technique de micropesée adaptée.
Dans le cas d'une analyse complète on peut, si l'on connait a priori les composés normalement présents dans l'échantillon (cas d'une analyse en ligne d'une production industrielle), exploiter sur plusieurs échantillons plusieurs méthodes colorimétriques spécifiques, ou parfois sur le même échantillon isoler successivement les divers constituants par précipitation. C'est plus ou moins long et précis car souvent il est pratiquement impossible de précipiter 100% du composé et le taux de précipitation dépend parfois aussi de la présence des autres constituants. Ainsi lorsque vous lisez sur l'étiquette d'une bouteille d'eau minérale sa teneur en nitrates ou en magnésium dites-vous bien qu'il s'agit d'un chiffre maximal indicatif d'un ordre de grandeur plutôt que d'un chiffre absolu car la composition de votre eau de source favorite évolue légèrement au cours du temps (avant d'être embouteillée) au gré des événements atmosphériques et qu'eu égard à la complexité de l'analyse, il y a fort peu de chances que votre bouteille ait subi un test analytique.
Un ensemble de méthodes d'analyse sont basées sur la création d'une chaine électrolytique et donc la mesure d'une tension et/ou d'un courant significatifs soit de l'espèce chimique (tension) soit de sa quantité (courant). On donnera ainsi l'exemple de la polarographie après avoir présenté la pHmétrie, ancêtre de toutes les méthodes électrochimiques d'analyse.
Les méthodes de la chimie traditionnelle étant peu adaptées à l'analyse de traces dans un mélange, on se tournera de plus en plus vers les méthodes optiques spectrométriques. En effet dans la majeure partie des cas une espèce chimique peut-être caractérisée par son spectre d'absorption qui est réellement spécifique. On peut ainsi soit balayer tout le spectre et identifier les pics spécifiques d'une espèce recherchée, soit se caler sur une longueur d'onde précise et mesurer l'intensité de l'absorption significative du nombre de molécules de l'espèce dans l'échantillon. On disposera pour cela de spectromètres de laboratoire mis au point depuis des décennies et, de plus en plus fréquemment, de microcapteurs fondés sur les méthodes combinant optique et nanotechnologies présentées au chap55.
Précisons que pour les analyses en microbiologie on a beaucoup utilisé des méthodes de comptage manuel sous microscope car fréquemment le problème n'est pas seulement une analyse chimique, mais, dans le monde du vivant, un dénombrement de certains microorganismes que l'on peut repérer visuellement grâce à un microscope. La technologie moderne apporte un complément intéressant à ces méthodes statistiques. En effet dans un certain nombre de cas on peut visualiser un type de microorganisme donné en le colorant. Il est alors aisé d'équiper le microscope d'un appareil photo numérique et de confier alors l'analyse quantitative à un logiciel spécifique de traitement d'image.
Parfois on transformera l'échantillon pour l'amener à l'état gazeux, et inversement on analysera parfois les gaz en les transformant en liquide. Les gaz peuvent être analysés par spectrométrie de masse mais aussi par diverses techniques optiques liées à l'absorption IR, UV et/ou la chimiluminescence

fig: ex d'analyseur
à fluorescence UV : les photons UV sont absorbés par l'espèce
chimique qui va réémettre des photons d'une autre longueur d'onde
comptabilisés par le biais d'un photomultiplicateur d'électrons.
Notons que la cellule pourrait être en milieu liquide aussi bien que gazeux
Les chapitres suivants examineront plus en détail les méthodes classiques et récentes d'analyse de gaz. Précisons enfin que les gaz ont une certaine solubilité dans les liquides, et tout particulièrement dans l'eau, solubilité dépendant évidemment de la température et de la pression. C'est le cas de l'oxygène et nous parlerons de l'oxymétrie dans le chapitre spécifique aux données environnementales.