
Copyright
© 2000-2015
LHERBAUDIERE
6 pages à l'impression
22 mars 2013
 |
Copyright |
6 pages à l'impression |
version
initiale 2002 |
||
| dernière
mise à jour 22 mars 2013 |
|
un
classique du labo |
||||
|
sa
version miniaturisée |
||||
|
la
chute des gouttes |
||||
|
pour
l'aquarium? |
||||
| une collection d'icônes pour visiter tout le site | ||||
![]() Dans cette catégorie, on va rencontrer deux principes de base :
Dans cette catégorie, on va rencontrer deux principes de base :
D'une part les capteurs thermodynamiques, dans lesquels , à courant nul, la tension galvanique aux bornes de la chaîne est une fonction directe du potentiel chimique µi de l'espèce i. La tension aux bornes constitue alors le signal du capteur. D'autre part, les capteurs cinétiques, dans lesquels existe une relation biunivoque entre la tension aux bornes de la cellule et l'intensité la traversant. La réponse de la chaîne organique à un signal électrique constitue alors la réponse du capteur. Cette dernière catégorie est certes d'application plus large, mais elle est moins sélective et nécessite toujours un étalonnage.
pHmètre
Le capteur type dans cette famille est certainement celui destiné à la mesure du pH. Rappelons que le pH caractérise le cologarithme de la concentration d'ions H+ dans une solution, et qu'on va le déterminer à partir de la mesure de la ddp entre deux électrodes particulières placées dans la solution à contrôler. Le couple d'électrodes le plus fréquemment rencontré est celui à électrode de mesure dite électrode de verre, d'une part, et électrode de référence au calomel, d'autre part, qui présente les caractéristiques métrologiques les plus satisfaisantes dans la majorité des cas.
 ..
..
A chaque interface correspond un potentiel supposé invariant pendant la mesure, cependant au niveau de l'électrode de verre dont la membrane est très fine (0.2mm) on constate la possibilité d'une diffusion d'ions H+ dans un sens ou l'autre selon l'acidité de la solution à mesurer. En milieu alcalin les ions H+ diffusent du verre vers l'extérieur créant une couche de charges négatives en surface de l'électrode et c'est l'inverse en milieu acide. Il en résulte une ddp entre les deux électrodes qui est significative, dès lors qu'il ne circule aucun courant, de la concentration en ions H+ dans la solution selon la loi établie par Nernst.
![]() dans laquelle U est la ddp entre les deux électrodes, Uo une constante,
R la constante des gaz parfaits, T la température absolue, F le nombre
de Faraday, et aH+ l'activité des ions H+
dans laquelle U est la ddp entre les deux électrodes, Uo une constante,
R la constante des gaz parfaits, T la température absolue, F le nombre
de Faraday, et aH+ l'activité des ions H+
Typiquement la réponse d'un jeu d'électrodes est donc fonction à la fois du pH et de la température de la solution. La figure ci-dessous donne un exemple d'allure des caractéristiques d'un couple d'électrodes combinées au calomel réelles.
Diverses présentation sont imaginables pour un couple d'électrodes, néanmoins aujourd'hui ce sont les électrodes dites combinées, telles par exemple celles figurées ci-dessus, qui ont la faveur des utilisateurs. Cette organisation permet une miniaturisation. On obtient ainsi des électrodes pouvant atteindre moins de 2mm de diamètre utilisables dans des tubes à essai de volume réduit ou parfois ingérables telles celles utilisées en gastro-entérologie pour l'identification des phénomènes de reflux gastrique.
Plusieurs remarques vont présider à l'exploitation d'un tel couple d'électrodes dans un dispositif métrologique pratique. Tout d'abord la pente négative de cette caractéristique qui impliquera un nombre impair d'étages d'amplification pour obtenir une sortie plus traditionnelle de tension croissante avec le pH.
Le second point est la nécessité
de décaler la caractéristique pour obtenir 0V pour un pH=0 et
enfin il convient de prendre conscience de l'importance de l'impédance
de ce couple d'électrodes (la mesure implique un courant nul) et donc
de l'impédance d'entrée du dispositif électronique associé
(>107M ). On notera, en
outre, une erreur de linéarité pour les valeurs très
basses et très élevées de pH.
). On notera, en
outre, une erreur de linéarité pour les valeurs très
basses et très élevées de pH.
Ce sont ces trois remarques qui justifient le schéma électronique
ci-dessous.

![]() Précisons cependant, ainsi que le montre la loi de Nernst, que la fem.
mesurée est fonction de la température, que l'impédance
du circuit de mesure est importante mais elle aussi variable avec la température,
et que le vieillissement
d'un couple d'électrodes se traduit par une dérive de ses caractéristiques.
Cette dérive est de plusieurs natures : d'une part, la pente de la courbe
caractéristique s'affaiblit, d'autre part, l'impédance évolue
et enfin le temps de réponse s'accroît considérablement.
Précisons cependant, ainsi que le montre la loi de Nernst, que la fem.
mesurée est fonction de la température, que l'impédance
du circuit de mesure est importante mais elle aussi variable avec la température,
et que le vieillissement
d'un couple d'électrodes se traduit par une dérive de ses caractéristiques.
Cette dérive est de plusieurs natures : d'une part, la pente de la courbe
caractéristique s'affaiblit, d'autre part, l'impédance évolue
et enfin le temps de réponse s'accroît considérablement.
![]() Pour toutes ces raisons, il sera indispensable de réétalonner
très régulièrement un pHmètre, avec des solutions
de pH et de température parfaitement connues. On exploitera généralement
deux solutions tampons afin de mettre en évidence la dérive de
pente, mais aussi le décalage de zéro du pHmètre : à
pH 7 pour établir le point zéro mV (correction du décalage)
en jouant sur le pont de résistances à l'entrée + de l'ampli
A2 et pH 4 ou 9.2 pour la dérive de pente qu'on ajuste en modifiant le
gain au niveau de l'amplificateur A3. Dans un pHmètre automatisé,
piloté par un microprocesseur, cet ajustement du gain et du décalage
de zéro sera obtenu en utilisant des potentiomètres numériques
à la place des résistances ajustables, lesquels seront directement
contrôlés via le programme.
Pour toutes ces raisons, il sera indispensable de réétalonner
très régulièrement un pHmètre, avec des solutions
de pH et de température parfaitement connues. On exploitera généralement
deux solutions tampons afin de mettre en évidence la dérive de
pente, mais aussi le décalage de zéro du pHmètre : à
pH 7 pour établir le point zéro mV (correction du décalage)
en jouant sur le pont de résistances à l'entrée + de l'ampli
A2 et pH 4 ou 9.2 pour la dérive de pente qu'on ajuste en modifiant le
gain au niveau de l'amplificateur A3. Dans un pHmètre automatisé,
piloté par un microprocesseur, cet ajustement du gain et du décalage
de zéro sera obtenu en utilisant des potentiomètres numériques
à la place des résistances ajustables, lesquels seront directement
contrôlés via le programme.
On doit aussi examiner le temps de réponse d'un couple d'électrodes placées dans une solution tampon connue, s'il dépasse un certain seuil (quelques dizaines de secondes) c'est significatif d'une perte de porosité de l'électrode de verre et donc il vaut mieux changer celle-ci. De même si la ddp s'éloigne trop de zéro pour un pH 7 (50mV) on doit considérer que le couple d'électrode est défaillant.
Notons enfin que les pHmètres commercialisés ont généralement une résolution de 0.01pH, mais que leur précision n'est le plus souvent que de 0.02 voire 0.1 pH.
isfets
pH-mètre pour l'EPFL (Ecole Polytechnique Fédérale de Lausanne et Centre de Microtechniques de Neuchatel),
capteur de gaz (Université de l'Utah),
voire en greffant du silane sur le gate capteur sensible à l'ion argent (CHEMFET de l'Ecole Centrale de Lyon).
La figure ci-dessous montre une réalisation d'une telle structure.

polarographie
Le modèle de capteur cinétique le plus répandu est sans doute le polarographe dans lequel une électrode de mercure est soumise à un potentiel croissant par rapport au potentiel d'une électrode de référence au calomel. L'enregistrement de la courbe i = f(v) présente l'allure ci-dessous. Le rapport entre les niveaux de courant des paliers permet le dosage quantitatif, tandis que la mesure des tensions aux points d'inflexion m et m' permet l'analyse qualitative.

Pour éviter le phénomène de polarisation de l'électrode du à l'accroissement du nombre d'ions à sa surface, celle-ci est renouvelée constamment par le principe de la goutte tombante figuré ci-dessous. De nombreuses recherches sont en cours actuellement pour remplacer cette électrode liquide, dont l'emploi présente quelques difficultés pratiques, par une électrode miniaturisée solide non polarisable.
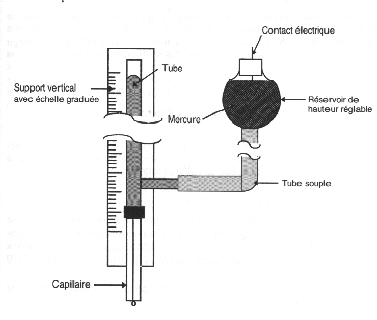
Dans ce principe on fait donc passer un courant entre une électrode fixe de référence, souvent au calomel, et l'électrode à goutte tombante et l'on opère donc une oxydation au niveau de l'électrode indicatrice. La hauteur du palier est proportionnelle à la concentration alors que la valeur de la tension à mi-palier est caractéristique de la substance oxydée sur l'électrode. L'intérèt de la goutte tombante est le renouvellement permanent de la surface de l'électrode ce qui élimine les phénomènes de polarisation, d'autre part la goutte tombant dans la solution produit une agitation au voisinage de l'électrode et donc un renouvellement de la solution, mais en contre partie le phénomène de dissolution anodique du mercure limite la plage de tension exploitable à 0.7V et donc le nombre de substances dosables par cette méthode.
Les produits dosables par cette méthode sont nombreux. En particulier les produits sulfurés contenus dans les gaz naturels (hydrogène sulfuré H2S, thiols R-SH) sont dissous dans une solution aqueuse de soude donnant du Na2S ou des R-SNa qui sont dosés par polarographie.
sonde à oxygène
La même technique peut être exploitée pour doser l'oxygène dissous dans une solution. La sonde à oxygène présente une géométrie un peu différente. C'est essentiellement un couple d'électrodes polarisables concentriques et séparées du milieu à tester par une membrane de polymère perméable au gaz. Une solution electrolytique appropriée (calomel) réalise un film de très faible épaisseur entre la membrane et la cathode.

L'oxygène diffusant à travers cette membrane est réduit au contact de la cathode sous l'effet d'une polarisation convenable ce qui se traduit par la création d'un courant directement proportionnel à la quantité d'oxygène qui a traversé la membrane significative de celle contenue dans la solution à tester.