
Copyright
© 2000-2015
LHERBAUDIERE
9 pages à l'impression
22 mars 2013
 |
Copyright |
9 pages à l'impression |
version
initiale 2002 |
||
| dernière
mise à jour 22 mars 2013 |
 L'OZONE ATMOSPHERIQUE
L'OZONE ATMOSPHERIQUEdeuxième partie (2/3): chimie de l'ozone
|
une introduction
|
||||
|
un cycle hyper complexe
|
||||
|
une réalité
méconnue
|
||||
|
une confirmation américaine
|
||||
| une collection d'icônes pour visiter tout le site | ||||
Pour fabriquer de l'ozone il faut apporter une certaine quantité d'énergie que seule l'énergie solaire peut naturellement fournir sous forme d'ultra violets de longueurs d'onde comprises entre 40 et 290 nm (ceux à très courtes longueurs d'onde qui justement sont les plus néfastes pour l'homme en terme de cancers de la peau et de risque de cataracte).
Les précurseurs sont essentiellement les oxydes d'azote, le CO, le méthane et les hydrocarbures imbrûlés, c'est à dire en grande partie, mais pas exclusivement loin de là, produits par les véhicules à moteur et majoritairement, contrairement à une idée reçue, ceux à essence.
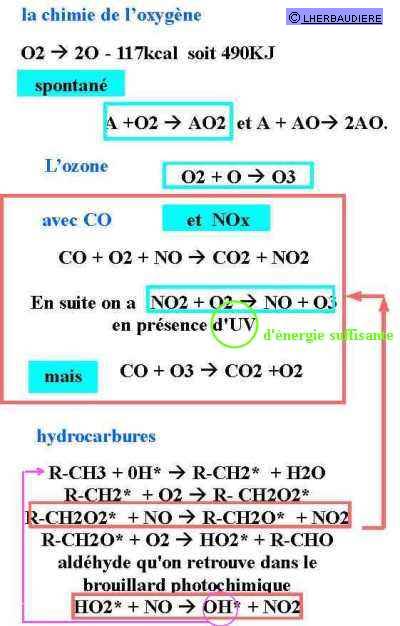
On notera que les réactions exploitant le CO sont lentes (2 à 3 semaines de rémanence), celles utilisant les hydrocarbures plus rapides (quelques heures à quelques jours). On notera aussi qu'en présence d'un radical OH* (résultant par exemple de la fracture d'une molécule d'eau par absorption d'un rayon cosmique) les hydrocarbures imbrûlés vont donner naissance à des composés de type aldéhyde qu'on va retrouver dans les brouillards photochimiques (qui obscurcissent légèrement le ciel au dessus de Paris par grand beau temps et provoquent des picotements des yeux), en outre il y a création de radicaux HO2* qui vont réagir avec les oxydes NO pour former du NO2 qui va lui conduire à la réaction de formation d'ozone dans la mesure où bien évidemment il y a des UV suffisamment énergétiques (donc de faible longueur d'onde!) pour assurer la rupture de la liaison, tandis que la dernière réaction figurant sur ce graphique conduit à la restitution du radical OH* responsable du début de la réaction en chaîne sur les hydrocarbures volatils imbrûlés qui va ainsi pouvoir continuer son action néfaste.
Par contre certaines molécules de CO vont réagir avec l'ozone pour le transformer en oxygène. Cette réaction se produit préférentiellement la nuit à plus basse température et donc en altitude, mais s'il y a une couche d'inversion de température à basse altitude (moins de 1km) l'ensemble des gaz d'échappement, des aldéhydes et de l'ozone éventuellement présent vont se retrouver piégés à basse altitude et c'est alors l'engrenage qui conduit au brouillard photochimique et aux pics de pollution dès lors qu'il fait beau c'est à dire lorsqu'il n'y a pas de nuages et peu d'ozone à haute altitude pour arrêter les UV.
L'ensemble des réactions, présentées ci-dessus, sont celles mises en avant par les pseudo-spécialistes pour nous convaincre du rôle néfaste de l'ozone et des polluants d'origine automobile dans l'obtention d'ozone au niveau du sol. Il ressort cependant de travaux systématiques menés à Lyon 2 que la réalité est infiniment plus complexe et qu'il convient d'être très prudent avant d'affirmer quoi que ce soit de manière péremptoire. En effet il y a des réactions chimiques lentes et d'autres qui sont beaucoup plus rapides et le bon sens nous laisse présager que les réactions rapides sont sans doute plus significatives.[11]
Enfin nous pouvons mentionner les interrogations fortes de certains chercheurs, et non des moins connus, tel Haroun Tazieff (cf le Figaro 23 novembre 1992) quant à la crédibilité de certaines assertions concernant le rôle des CFC dans la destruction de l'ozone à haute altitude et le constat simultané que les brevets des CFC incriminés tombant dans le domaine public entraineraient une considérable perte de revenus pour les groupes chimiques internationaux détenteurs de ces brevets et qui auraient donc tout intérèt à promouvoir d'autres produits plus récemment brevetés dans le marché de la réfrigération afin de garder leur position monopolistique.[14]
Le cycle de l'ozone est en fait d'une extraordinaire complexité car la majorité des réactions chimiques mises en jeu sont des équilibres pouvant évoluer dans les deux sens selon les conditions : apport d'énergie ou absorption d'un des composés par le biais d'une autre réaction, selon le schéma générique ci-dessous : l'apport d'énergie favorise la formation des composés C et D, tandis que la disparition de B par absorption dans une autre réaction va favoriser le déplacement de l'équilibre vers la gauche. De même l'absorption dans une autre réaction de C ou de D favoriserait la réaction inverse, c'est à dire vers la droite.
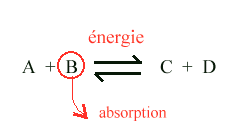
On va retrouver l'ensemble de ces mécanismes dans la plupart des réactions qui favorisent la création ou la destruction de l'ozone.
Dans la figure ci-dessous nous avons tenté de rassembler l'essentiel des réactions chimiques participant au cycle de l'ozone à haute et basse altitude afin d'illustrer cette complexité (5). Ce tableau est très incomplet car n'y figurent pas l'ensemble des centaines de réactions faisant intervenir des produits chimiques de synthèse rarement répandus dans l'atmosphère, mais pouvant l'être occasionnellement par accident, et qui alors pourraient induire une augmentation locale considérable de l'ozone atmosphérique à basse altitude (ou inversement sa destruction accélérée). Ce tableau est le résultat, supposé valable en mars 2000 de la compilation de nombreuses publications dans des revues soit-disant sérieuses que je n'ai évidemment pu vérifier. Il m'apparait simplement avec le recul que certaines publications initiales (parfois couronnées d'un prix Nobel) ont été validées et admises comme la vérité sans aucune contre expertise ce qui, compte tenu de la gravité du sujet, me laisse perplexe. Il faut donc considérer ce tableau non comme une image de la réalité mais comme une image de la complexité du problème et de la méconnaissance réelle que nous en avons.
Sur cette figure nous avons fait figurer en vert et en bleu les principales réactions causées par l'activité humaine et dont le résultat est une perturbation du cycle naturel de l'ozone.
Remarquons que selon leur longueur d'onde les UV vont favoriser la création d'ozone ou au contraire sa destruction et les fluctuations de concentration d'ozone en haute atmosphère sont effectivement liées à l'évolution de l'émission d'UV par le soleil (fonction de l'activité variable et encore très malconnue de celui-ci au cours du temps, éruptions solaires, taches solaires, ...) et simultanément la rotation annuelle de la terre autour du soleil suivant une ellipse, elle, au contraire, parfaitement connue.

Suite aux compléments d'information que nous avons reçus de divers collègues ayant lu cette page web depuis sa création, nous ajoutons à votre réflexion les éléments suivants :
Toutes les mesures d'ozone, effectuées par les réseaux agréés, sont perturbées par la présence de réactions rapides et irréversibles entre l'ozone et certains éléments tels NO et divers polluants volatils (COV). La réaction basique étant la suivante:
O3 + NO --> NO2 + O2 et NO2 +O3 --> NO3
Il est piquant de remarquer que ces réactions sont exactement les inverses de celles proposées dans le tableau précédent pour expliquer la fabrication d'ozone à basse altitude. Complémentairement NO3 est un réactif puissant qui réagit avec de nombreux polluants volatils tels que les hydrocarbures imbrûlés, l'essence sans Pb, etc...
Enfin les travaux menés à Lyon 2 aboutissent à la conclusion suivante : Il est impossible de synthétiser O3 dans la troposphère sous rayonnement solaire même en présence d'excès de NO2 et de polluants de toutes sortes...
Enfin pour mieux comprendre la chimie de l'ozone nous vous conseillons la lecture du document rédigé par P. Baumgartner présent sur ce site.
l'automobile
Le rôle de l'automobile est important dans la formation de polluants à basse altitude, mais contrairement aux idées reçues et véhiculées par les médias c'est le moteur à essence sans plomb qui est la plus importante source de pollution et en particulier des soit-disants précurseurs de l'ozone. En effet ainsi que le montre le tableau ci-dessous, issu de travaux d'organismes scientifiques rigoureux (1), ce qui caractérise la différence essentielle entre un moteur à essence et un moteur à gazole est que celui à gazole va presque intégralement brûler son carburant, alors que celui à essence, généralement sous alimenté en air (c'est à dire en oxygène) ou si l'on préfère suralimenté en carburant, ne le peut pas. Incidemment cela explique pourquoi à puissance égale un moteur à gazole consomme environ 30% de carburant de moins que le moteur à essence, alors que la quantité d'énergie susceptible d'être récupérée par combustion est sensiblement la même dans un litre de gazole et un litre d'essence.
Un autre élément qui explique pourquoi le moteur à essence sans plomb est beaucoup plus polluant est lié au fait que ce moteur travaille à une bien plus faible pression que celui à gazole, et dans ces conditions thermodynamiques pour obtenir une combustion relativement efficace on a du introduire dans l'essence sans plomb une quantité considérable (jusqu'à 40%) de composés de la famille du benzène (benzène, xylènes, toluène...) dont on sait généralement qu'ils sont cancérigènes et dont on sait beaucoup moins qu'ils ont des effets neurophysiologiques gravissimes (le toluène en particulier, mais sans doute aussi les xylènes, s'attaque à la structure chimique de la myéline...pour simplifier disons qu'il dissout les neurones, et le conseil que je pourrais donner est d'éviter de respirer des vapeurs d'essence sans plomb). (6)
A la sortie d'un pot d'échappement de moteur à essence sans plomb on retrouve donc divers constituants plus ou moins imbrûlés dont beaucoup vont avoir une incidence sur la création d'ozone, en particulier le monoxyde de carbone. Longtemps les moteurs à gazole ont été considérés comme plus polluants parce qu'ils émettaient des particules de carbone visibles en particulier lors d'une accélération. Ceci reste vrai pour les moteurs anciens, mais les progrès réalisés par les constructeurs dans le domaine du recyclage des imbrûlés et du filtrage des particules font que ce n'est plus vrai pour les moteurs modernes depuis plusieurs années déjà. A tel point que les responsables de l'environnement de Californie, dont on connait les problèmes de pollution à Los Angelès, commencent à considérer avec intérèt la solution diesel. C'est d'ailleurs l'agence fédérale de l'environnement américaine qui a annoncé en tout premier, bien avant sa commercialisation sur la 607, l'arrivée du nouveau filtre à particules du groupe Peugeot en saluant sa qualité innovante et son efficacité. En ce qui concerne les moteurs à essence récents le recyclage des gaz a permis une sensible amélioration à régime constant, cependant en accélération aussi bien qu'en décélération les progrès sont moindres et l'émission d'imbrûlés et surtout de monoxyde de carbone restent très supérieurs à ce que produit un moteur diesel de puissance comparable.
![]() Notons
une nouvelle polémique lancée par les opposants au diesel : puisqu'il
est avéré que les particules visibles de carbone émises
par les moteurs récents sont quasi-disparues on nous annonce maintenant
que ce n'était pas ces particules qui étaient dangereuses mais
les particules les plus fines de l'ordre du micron de diamètre (donc
non visibles à l'oeil nu) et que ces particules ne seraient pas arrêtées
par les filtres des moteurs diesel... peut-être, mais que dire des particules
semblables émises par les moteurs à essence, sont elles douées
d'un sens civique supérieur et se fixent-elles sur les filtres ? La réponse
est évidemment non, et comme le moteur à essence consomme plus
que celui à gazole...
Notons
une nouvelle polémique lancée par les opposants au diesel : puisqu'il
est avéré que les particules visibles de carbone émises
par les moteurs récents sont quasi-disparues on nous annonce maintenant
que ce n'était pas ces particules qui étaient dangereuses mais
les particules les plus fines de l'ordre du micron de diamètre (donc
non visibles à l'oeil nu) et que ces particules ne seraient pas arrêtées
par les filtres des moteurs diesel... peut-être, mais que dire des particules
semblables émises par les moteurs à essence, sont elles douées
d'un sens civique supérieur et se fixent-elles sur les filtres ? La réponse
est évidemment non, et comme le moteur à essence consomme plus
que celui à gazole...
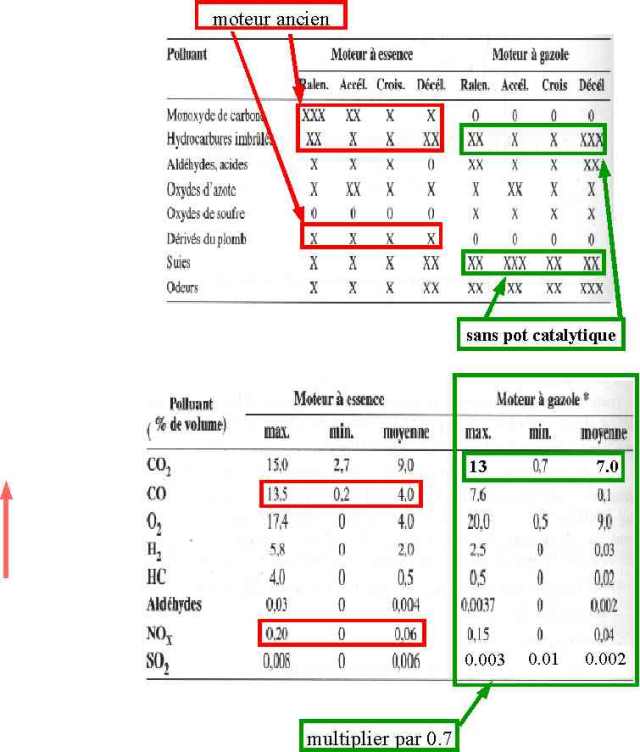
Les chiffres ci-dessus sont exprimés en volume, c'est à dire pour un litre de gaz d'échappement, sachant qu'à puissance identique un moteur diesel consomme environ 30% de carburant de moins que le moteur à essence, il convient de multiplier par 0.7 pour pouvoir comparer plus objectivement les deux moteurs.
l'agriculture
N'oublions cependant pas les engrais azotés qui représentent en été, en France, environ six fois (oui vous avez bien lu : six fois) la pollution automobile. Notons que la décomposition naturelle (fermentation bactérienne) conduit à environ 95% d'azote et 5% de NO, à la différence de la destruction des nitrates par les microorganismes qui génère du NO2. L'un (naturel) est plutôt favorable à la destruction de l'ozone tandis que l'autre (résultant de l'anerie des hommes) est un précurseur de sa fabrication à basse altitude. Précisons que d'après des travaux de l'INRA on peut admettre qu'environ un tiers des engrais azotés utilisés en France sert à produire de la plante, un tiers se retrouve dans les nappes phréatiques avec les problèmes que l'on connait en particulier en Bretagne, et l'autre tiers, celui qui nous intéresse ici, est détruit par les microorganismes. Le bon sens nous apprend que ces microorganismes sont sans doute plus actifs en été qu'au milieu de l'hiver d'où cette importance gigantesque sur la création d'ozone en été.
Il est d'ailleurs très intéressant de noter qu'une étude de l'agence américaine de l'environnement (EPA) datant de 1988 a montré que la pollution par l'ozone réduisait le rendement des champs de céréales d'un montant estimé à la bagatelle de 3 milliards de dollars par an aux USA, soit près de 30% de pertes! En effet l'ozone réagit sur la surface supérieure des feuilles en perturbant le processus de photosynthèse, on utilise d'ailleurs quelquefois des plantes particulièrement sensibles comme indicateur de pollution par l'ozone en milieu urbain ou rural. On aboutit donc à ce paradoxe que l'excès d'engrais est à la fois un facteur de pollution mais aussi de perte de rendement!
la forêt
Précisons enfin que, parmi les sources de précurseurs de l'ozone, il y a certains arbres qui en été, par forte chaleur, exsudent par leurs feuilles des composés terpéniques (regardez les feuilles de bouleau par exemple) qui vont donc favoriser cette fabrication d'ozone. Ce qui explique qu'on enregistre dans les forêts en été des taux d'ozone équivalents à ceux des centres des agglomérations, mais aussi que les parcs et jardins publics en ville sont parfois moins attrayants qu'il n'y parait. Ce processus naturel est peut-être cependant d'importance globalement moindre que les précédents.
En fait actuellement on n'est pas encore en mesure d'évaluer les contributions respectives des différentes sources de pollution dans l'apparition des pics d'ozone. Si l'on en croit R. Vautard, directeur de recherche à Polytechnique les moyens mis en oeuvre dans le cadre du projet ESQUIF (étude et simulation de la qualité de l'air en Ile-de-France) devaient permettre d'y voir plus clair d'ici l'été 2001 [15], mais en début 2005 les résultats de cette étude nous sont toujours inconnus!.
quelques résultats statistiques complémentaires
Il ne suffit pas d'examiner les divers facteurs de la chimie de l'ozone, mais il est aussi très instructif d'analyser quelques statistiques provenant des USA (8) et montrant l'ampleur du rôle joué par les composés organo-chlorés dans la destruction de la couche d'ozone qui nous protège des UV et que l'on a mise en évidence à la fin des années 70.
Ces graphiques se passent de commentaires. Nous préciserons cependant que les CFC communément appelés fréons ont été inventés aux USA il y a un peu plus de 60 ans, pays qui en a été le plus grand utilisateur dans les systèmes de réfrigération et de climatisation tant dans l'habitat que dans l'automobile, mais qui depuis une dizaine d'années semble avoir réellement pris la mesure de la catastrophe écologique résultant des fuites de ces produits vers la haute atmosphère et fortement réduit leur emploi. Une première prise de conscience mondiale a conduit à la Convention de Vienne entrée en vigueur en 1988, puis le protocole de Montréal en 1991-92 interdisant totalement la fabrication des CFC au 1er janvier 1996 dans les pays industrialisés, et les CFC sont désormais interdits dans les réfrigérateurs (ce qui incidemment explique pourquoi les nouveaux réfrigérateurs ont une durée de vie plus faible que les anciens, notons aussi que les composés de remplacement utilisés aujourd'hui s'ils ne risquent plus, lors des inévitables fuites dans l'atmosphère, de détruire la couche d'ozone, présentent l'inconvénient tout aussi dramatique de participer à l'effet de serre). Les projections des scientifiques imaginaient alors que le trou de la couche d'ozone allait se résorber progressivement et que la situation redeviendrait normale vers le milieu du 21ème siècle. C'était sans doute très optimiste car tous les états n'ont pas signé le protocole de Montréal (140 l'ont fait) et il semble bien que certains pays en voie de développement continuent à produire des CFCs, et d'ailleurs le 3 septembre 2000 a vu un nouveau record franchi dans l'étendue de la zone de déplétion sur l'Antarctique.
Enfin nous donnons ci-dessous le résultat supposé de ces excès de CFCs rejetés dans l'atmosphère.
Mais n'y a-t-il pas d'autres explications ou une conjonction d'autres phénomènes que l'on n'a pas identifiés. Deux remarques militent en faveur d'une telle interrogation : la première provient des travaux de P. Baumgartner & al. [12] qui ont tenté de mettre en évidence en laboratoire l'influence des CFCs sur la décomposition de O3 et ont abouti à la conclusion que les atomes de Chlore n'avaient pas de rôle catalytique dans cette décomposition. La seconde provient de l'examen du diagramme ci-dessous : pourquoi en 1988 la couche d'ozone s'est elle sensiblement reconstituée...y aurait-il eu cette année là une diminution sensible des fuites de CFCs? Ce n'est pas ce que montrent les autres diagrammes de la NASA dont nous n'avons aucune raison de mettre en doute la validité.
Alors quelle en est la cause ? La conclusion que le scientifique doit en tirer c'est que le problème est sans doute beaucoup plus complexe qu'on ne l'imaginait et qu'il serait indispensable de mener des travaux complémentaires.
Mais cela ne doit pas conduire les gouvernants à ne rien faire contre la dissémination des CFCs et à ne rien faire pour réduire les pollutions de toutes sortes.